Giới thiệu
Ung thư phổi không tế bào nhỏ (NSCLC) đột biến thụ thể yếu tố tăng trưởng biểu bì (EGFR) chiếm khoảng 15–20 % tổng số ca NSCLC tại châu Á. Sự xuất hiện của các thuốc ức chế tyrosine kinase (EGFR-TKI) đã thay đổi hoàn toàn tiên lượng nhóm bệnh nhân này. Trong số đó, osimertinib – TKI thế hệ 3 – nổi bật nhờ khả năng khắc phục đột biến kháng T790M và xuyên hàng rào máu-não tốt. Bài viết tổng hợp dữ liệu từ những thử nghiệm quan trọng nhất, giúp độc giả đánh giá toàn diện hiệu quả lâm sàng của osimertinib trên mọi giai đoạn điều trị.
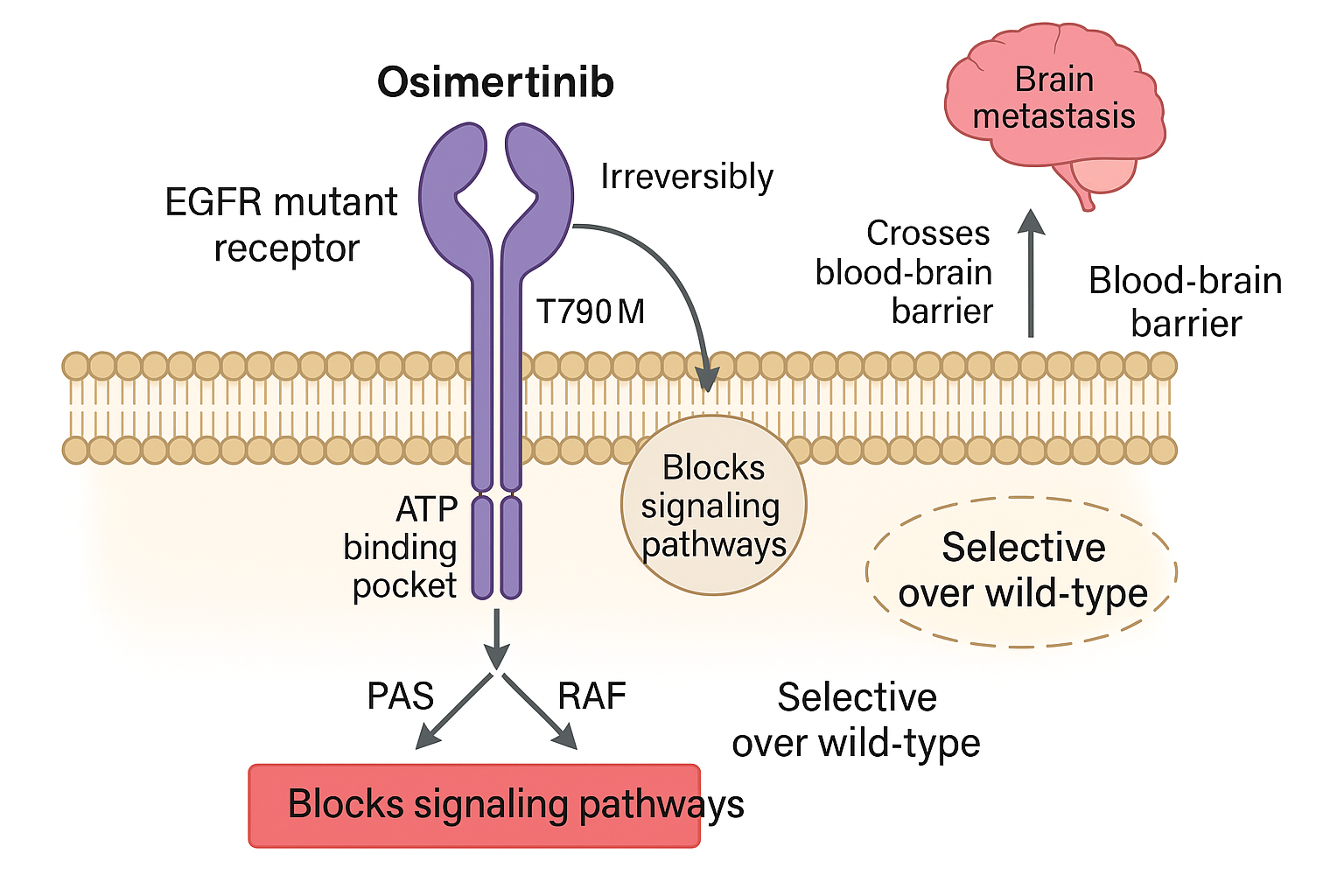
Cơ chế tác dụng và ưu thế thế hệ 3
Osimertinib gắn không hồi phục vào EGFR mang đột biến hoạt hoá (ex19 del, L858R) và đột biến kháng T790M, đồng thời ít ức chế EGFR wild-type nên giảm độc tính da–tiêu hoá. Phân tử có độ ưa lipophil vừa phải, cho phép thấm tốt vào hệ thần kinh trung ương (CNS), nhờ đó giảm đáng kể nguy cơ và tiến triển di căn não.
Nghiên cứu AURA – nền tảng phê duyệt hàng 2 (T790M+)
AURA extension & AURA2 (pha II)
· Thiết kế: đơn nhánh, 80 mg x 1 lần/ngày.
· Dân số: 411 bệnh nhân NSCLC tiến triển, mang đột biến kháng T790M.
· Kết quả: ORR 62 %; PFS trung vị 12,3 tháng; CNS-ORR 54 % và DCR 92 % ở bệnh nhân có di căn não.
· Giải thích thuật ngữ:
- ORR là viết tắt của Objective Response Rate – “tỷ lệ đáp ứng khách quan” trong thử nghiệm lâm sàng ung thư.
- CNS là viết tắt của Central Nervous System – hệ thần kinh trung ương, bao gồm:
Não (cerebrum, tiểu não, thân não).
Tuỷ sống.
Tại sao cụm từ “CNS” được nhắc nhiều trong các nghiên cứu ung thư phổi?
Di căn não/tuỷ rất hay gặp ở ung thư phổi, đặc biệt là NSCLC đột biến EGFR.
Hàng rào máu-não (BBB) hạn chế phần lớn thuốc hoá trị đi vào CNS, nên bệnh nhân dễ tái phát hoặc tiến triển tại não dù kiểm soát tốt ở ngoài não.
Thử nghiệm lâm sàng thường báo cáo các chỉ số riêng cho CNS:
CNS-ORR (Objective Response Rate trong não).
- CNS-PFS (Progression-Free Survival tính riêng cho tổn thương não).
Những thuốc như osimertinib có khả năng thấm CNS tốt, nên cho thấy tỷ lệ di căn não mới thấp hơn và kiểm soát tổn thương não tốt hơn so với TKIs thế hệ cũ.
DCR là viết tắt của Disease Control Rate – “tỷ lệ kiểm soát bệnh”, một chỉ số hiệu quả thường được báo cáo trong các nghiên cứu ung thư.
Ý nghĩa lâm sàng:
Cho thấy mức độ “giam giữ” bệnh – không chỉ đáp ứng (thu nhỏ) mà còn ngăn bệnh tiến triển.
Hữu ích trong pha I–II khi mục tiêu là xác định hoạt tính ban đầu của thuốc, đặc biệt với liệu pháp có thể không gây co khối u nhanh (ví dụ: miễn dịch, liệu pháp đích thế hệ mới).
Luôn được xem cùng các chỉ số khác (ORR, PFS, OS) để đánh giá toàn diện hiệu quả điều trị.
AURA3 (pha III)
So sánh: osimertinib vs hoá trị platinum-pemetrexed (tỉ lệ 2:1).
- PFS: 10,1 vs 4,4 tháng (HR 0,30).
PFS là viết tắt của Progression-Free Survival – thời gian sống thêm không tiến triển (hoặc “thời gian bệnh không tiến triển”).
- OS: 26,8 vs 22,5 tháng (HR 0,87) – lợi ích bị làm mờ do crossover 67 %.
OS là viết tắt của Overall Survival – thời gian sống còn toàn bộ.
Ý nghĩa: Khẳng định osimertinib là tiêu chuẩn hàng 2 cho bệnh nhân EGFR-T790M.
Điều trị hàng 1 di căn – FLAURA & FLAURA2
FLAURA (pha III)
· So sánh: osimertinib vs erlotinib/gefitinib.
· PFS: 18,9 vs 10,2 tháng (HR 0,46).
· OS: 38,6 vs 31,8 tháng (HR 0,80).
· CNS-PD trong 24 tháng: 19 % vs 43 %.
FLAURA2 (pha III)
· Thiết kế: osimertinib đơn trị so với osimertinib + pemetrexed/platinum.
· PFS: 25,5 vs 16,7 tháng (HR 0,62).
· Ý nghĩa: Phối hợp hoá trị hữu ích ở bệnh nhân gánh nặng u cao hoặc nguy cơ CNS.
Bổ trợ sau phẫu thuật – ADAURA
· Dân số: 682 bệnh nhân giai đoạn IB–IIIA, hoàn tất cắt bỏ ± hoá trị bổ trợ.
· Thiết kế: osimertinib 80 mg x 3 năm vs placebo.
· OS 5 năm (toàn bộ quần thể): 88 % vs 78 % (HR 0,49).
· Đồng nhất lợi ích ở mọi cN, pT và liệu có hoặc không hoá trị.
Duy trì sau hoá-xạ trị giai đoạn III không cắt được – LAURA
Dân số: 216 bệnh nhân unresectable stage III EGFRm, không tiến triển sau CRT.
Thiết kế: random 2:1 osimertinib vs placebo ≤ 36 tháng.
PFS: 39,1 vs 5,6 tháng (HR 0,16).
Tổn thương não mới: 8 % vs 29 %.
OS tạm thời (31 % sự kiện): median 58,8 vs 54,1 tháng; HR 0,67 – cần theo dõi chín muồi.
Các chiến lược sau kháng thuốc – ORCHARD và hơn thế nữa
ORCHARD – mô-đun Osi + Datopotamab Deruxtecan (Dato-DXd):
ORR 36–43 %, median PFS 9,5–11,7 tháng.
Thử nghiệm với amivantamab ± lazertinib, TKI thế hệ 4… đang diễn ra.
Hồ sơ an toàn
Phân tích tích luỹ cho thấy:
ADR thường gặp: tiêu chảy, phát ban, viêm da tay-chân, viêm phổi sau xạ.
ADR độ ≥3: 10–15 % trong các thử nghiệm giai đoạn sớm; tăng lên ~35 % ở LAURA (ảnh hưởng CRT).
Theo dõi đặc biệt: QTc, phổi kẽ, độc tính tim mạch sớm.
Hướng dẫn & phê duyệt
FDA: phê duyệt osimertinib cho hàng 1 (2018), bổ trợ (2020), kết hợp hoá trị (02/2024) và duy trì sau CRT (09/2024).
EMA: chấp thuận các chỉ định tương tự, phê duyệt LAURA đầu 2025.
NCCN 2025: xếp osimertinib hạng I ở tất cả bối cảnh trên.
Kết luận
Chuỗi thử nghiệm AURA → FLAURA → ADAURA/LAURA/NeoADAURA đã đưa osimertinib trở thành xương sống điều trị NSCLC đột biến EGFR trên toàn bộ quang phổ bệnh. Thuốc không chỉ kéo dài mạnh mẽ PFS/OS mà còn bảo vệ hệ thần kinh trung ương vượt trội, thiết lập tiêu chuẩn mới ở giai đoạn sớm và trung gian. Việc triển khai rộng rãi xét nghiệm EGFR và tối ưu hoá phác đồ tại Việt Nam sẽ góp phần nâng cao thời gian sống và chất lượng sống cho bệnh nhân.